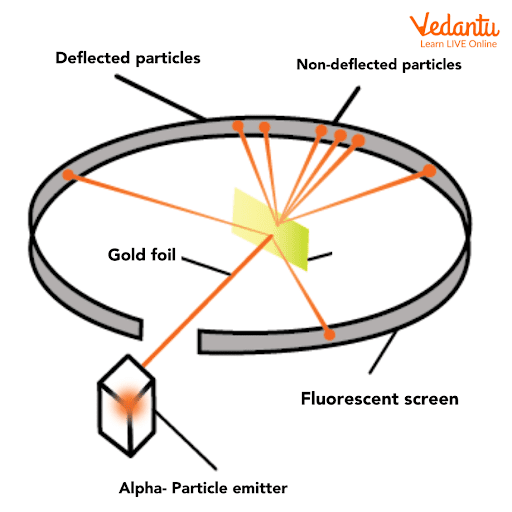
রাদারফোর্ডের আলফা কণা বিচ্ছুরণ পরীক্ষা
রাদারফোর্ডের আলফা কণা বিচ্ছুরণ পরীক্ষাটি ছিল একটি যুগান্তকারী পরীক্ষা যা পরমাণুর গঠন সম্পর্কে আমাদের বোঝার ক্ষেত্রে বিপ্লব ঘটিয়েছিল। পরীক্ষার সংক্ষিপ্ত বিবরণ: রাদারফোর্ড একটি পাতলা সোনার পাতের উপর আলফা কণার (ধনাত্মক চার্জযুক্ত হিলিয়াম নিউক্লিয়াস) একটি রশ্মি নিক্ষেপ করেন। তিনি দেখতে পান যে বেশিরভাগ আলফা কণা সোজা পাতটি ভেদ করে চলে যায়, কিন্তু কিছু কণা বিভিন্ন কোণে […]
রাদারফোর্ডের আলফা কণা বিচ্ছুরণ পরীক্ষা Read Post »